| Ácido | Base | |
|---|---|---|
| Definición | Un ácido es una sustancia que es capaz de liberar iones de hidrógeno H+ en solución. | Una base es una sustancia capaz de disociar iones de hidróxido OH- en una solución. |
| Teoría de Arrhenius | Es una sustancia que libera iones de hidrógeno H+ en solución acuosa. | Es una sustancia que disocia un anión hidróxido OH- en un medio acuoso. |
| Teoría Brønsted-Lowry | Son sustancias con la capacidad de donar o ceder protones (átomos de hidrógeno sin su electrón negativo: H+). | Es una sustancia capaz de aceptar protones (H+) en disolución. |
| Teoría de Lewis | Es una sustancia capaz de aceptar un par de electrones. | Es una sustancia que tiene la capacidad de donar o ceder electrones. |
| Propiedades |
|
|
| Nivel de pH | Inferior a 7. | Superior a 7. |
| Ejemplos |
|
|
sábado, 11 de julio de 2020
lunes, 25 de mayo de 2020
domingo, 24 de mayo de 2020
CLASES DE MATERIA
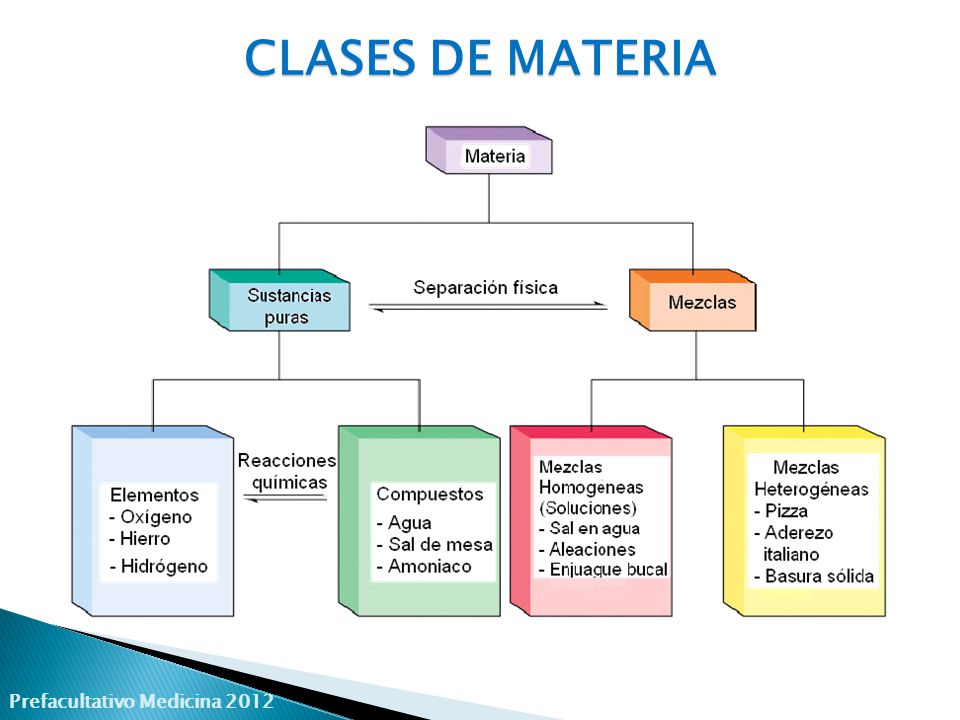
Una SUSTANCIA PURA es aquella compuesta por un solo tipo de materia,
presenta una composición fija y se puede caracterizar por una serie de
propiedades específicas. Las sustancias puras no pueden separarse en sus
componentes por métodos físicos. Según la composición química, las sustancias puras
se clasifican en: sustancias simples o elementos químicos, y sustancias compuestas o
compuestos químicos.
Un
elemento químico es una sustancia pura, que no
puede descomponerse en otras más sencillas que ella. El hierro (Fe), el oro
(Au) y el oxígeno (O) son ejemplos de elementos químicos
Un compuesto químico es una sustancia pura,
formada por la combinación química de dos o más elementos, en proporciones definidas.
Por ejemplo, agua, sal de cocina (NaCl), amoniaco.
Las MEZCLAS
son uniones físicas de sustancias en las que la estructura de cada sustancia no
cambia, por lo cual sus propiedades químicas permanecen constantes y las
proporciones pueden variar. Además, es posible separarlas por procesos físicos.
Por ejemplo, la unión de agua con tierra es una mezcla. En una mezcla, la
sustancia que se encuentra en mayor proporción recibe el nombre de fase dispersante o
medio, y la sustancia que se encuentra en menor
proporción recibe el nombre de fase dispersa.
Las MEZCLAS
pueden ser homogéneas o heterogéneas:
- Suspensiones: son las mezclas en las que se aprecia con mayor claridad la separación de las fases. Generalmente están formadas por una fase dispersa sólida insoluble en la fase dispersante líquida, por lo cual tienen un aspecto opaco y, si se dejan en reposo, las partículas de la fase dispersa se sedimentan. El tamaño de las partículas de la fase dispersa es mayor que en las disoluciones y en los coloides. Por ejemplo, el agua con arena es una suspensión.
- Coloides:
son
mezclas heterogéneas en las cuales las partículas de la fase dispersa tienen un
tamaño intermedio entre las disoluciones y las suspensiones, y no se sedimentan.
Las partículas coloidales se reconocen porque pueden reflejar y dispersar la
luz. Por ejemplo, la clara de huevo y el agua jabonosa son coloides.
domingo, 22 de marzo de 2020
SIMULADOR DE pH
En este link pueden hallar el pH de varias sustancias, totalmente pura y en solución:
Manos a la obra a calcular pH!!!
miércoles, 18 de marzo de 2020
"pH" Potencial de Hidrógeno
El pH
El pH es una medida de acidez o alcalinidad que indica la cantidad de iones de hidrógeno presentes en una solución o sustancia.
Las siglas pH significan potencial hidrógeno o potencial de hidrogeniones, del latín pondus: peso, potentia: potencia e hydrogenium: hidrógeno, es decir pondus hydrogenii o potentia hydrogenii.
El terminó fue designado por el químico danés Sorense al definirlo como el opuesto del logaritmo en base 10 o el logaritmo negativo de la actividad de los iones de hidrógeno, cuya ecuación es pH= -log10[aH+].
ESCALA DE pH


CALCULO DE pH
 Los invito a buscar más vídeos para aclarar dudas
Los invito a buscar más vídeos para aclarar dudas


CALCULO DE pH
Estos vídeos muestran como se calcula el pH:
 Los invito a buscar más vídeos para aclarar dudas
Los invito a buscar más vídeos para aclarar dudasÁCIDO Y BASES
ÁCIDO Y BASE
Un ácido es una sustancia que es capaz de liberar iones de hidrógeno (H+) en una solución. Sin embargo, también se considera como un ácido una sustancia que puede recibir un par de electrones.
En cuanto a la base, esta se considera como una sustancia capaz de disociar iones de hidróxido (OH-) en una solución. Además, también son consideradas aquellas sustancias capaces de donar un par electrones.
Tanto ácidos como bases pueden ser identificados según su posición en la escala del pH. En el caso de los ácidos, estos tienen un valor inferior a 7, mientras que las bases (alcalinos) tienen uno superior a 7.
Observa los vídeos:
Observa lo que ocurre en nuestro estómago!!
Suscribirse a:
Entradas (Atom)